Blog de apoyo a las clases. Busca tu curso o el tema que te interesa en las ETIQUETAS.
miércoles, 31 de octubre de 2012
Control del SISTEMA PERIÓDICO bachillerato
Debeis conocer los elementos representativos, para aprobar sólo podéis tener 5 fallos.
BA1ºD LUNES
BA1ºE MARTES
BA1ºD LUNES
BA1ºE MARTES
sábado, 27 de octubre de 2012
Selectividad 2012
Os pongo el examen del año pasado para que os hagáis una idea de lo que piden y de lo importante que es que este año aprendáis todo lo posible para conseguir tener el nivel adecuado.
http://www.spaindata.com/quimica/madrid/index.html
http://www.clasesdeapoyo.com/selectividad/Qu%C3%ADmica
http://selectividad.intergranada.com/Quimica/Clase/Sel-Madrid.pdf
Examen Selectividad Madrid Química 2012
http://www.spaindata.com/quimica/madrid/index.html
http://www.clasesdeapoyo.com/selectividad/Qu%C3%ADmica
http://selectividad.intergranada.com/Quimica/Clase/Sel-Madrid.pdf
Examen Selectividad Madrid Química 2012
jueves, 25 de octubre de 2012
Ex bachillerato tema 3: MARTES 30/10/12
Os recuerdo que ya deben estar hechos todos los problemas y el próximo día lo dedicaremos a terminar de corregir y dudas.
El día del examen hago revisión de cuaderno, por eso completa lo que te falte.
Además, como os dije al empezar el tema debéis saber los elementos representativos del SP, pues para hacer configuraciones sin nº atómico como pongo en los ejercicios de repaso:
PARA REPASAAR OS PONGO UNOS EJERCICIOS RESUELTOS, o no DE SELECTIVIDAD:
1-- Para el segundo elemento alcalinotérreo y para el tercer elemento del grupo de los halógenos:
Escriba los cuatro números cuánticos de su último electrón.
SOLUCION:
(3, 0 , 0, ±½) y (4, 1, −1, ± ½); (4, 1, 0, ±½); (4, 1, 1, ± ½) nota: es válido cualquiera de los 3
2--Indique si las siguientes afirmaciones son verdaderas o falsas, justificando la respuesta.
El día del examen hago revisión de cuaderno, por eso completa lo que te falte.
Además, como os dije al empezar el tema debéis saber los elementos representativos del SP, pues para hacer configuraciones sin nº atómico como pongo en los ejercicios de repaso:
PARA REPASAAR OS PONGO UNOS EJERCICIOS RESUELTOS, o no DE SELECTIVIDAD:
1-- Para el segundo elemento alcalinotérreo y para el tercer elemento del grupo de los halógenos:
Escriba los cuatro números cuánticos de su último electrón.
SOLUCION:
(3, 0 , 0, ±½) y (4, 1, −1, ± ½); (4, 1, 0, ±½); (4, 1, 1, ± ½) nota: es válido cualquiera de los 3
2--Indique si las siguientes afirmaciones son verdaderas o falsas, justificando la respuesta.
a)
Un fotón con frecuencia 2000 s-1 tiene mayor longitud de onda que otro con
frecuencia 1000 s-1.
b)
De acuerdo al modelo de Bohr, la energía de un electrón de un átomo de
hidrógeno en el nivel n = 1 es cuatro veces la energía del nivel n = 2.
c)
Cuando un átomo emite radiación, sus electrones pasan a un nivel de energía
inferior.
d)
Los números cuánticos (3, 1, 1, +1/2) corresponden a un electrón de la
configuración electrónica fundamental del átomo de carbono.
3--Para los elementos A, B, C y D, de números atómicos 3, 10, 20 y 35,
respectivamente:
a) Escribe la configuración electrónica de cada uno de ellos.
b) Indica su situación en la tabla periódica. (período y grupo).
c) Justifica si los siguientes números cuánticos pueden corresponder a los electrones más
externos de alguno de ellos, indicando a cuál: (2, 1, 0, + 1/2); (3, 0, 1,+ 1/2); (3, 2, 1, +
1/2); (4, 1, 1, + 1/2).
d) Justifica cuál de estos elementos tienen la menor reactividad química.
Solución:
a)
b) La situación de los elementos en un período se determina por el valor del número cuántico
principal n, mientras que el grupo se obtiene según el valor de los electrones en su capa de valencia.
El elemento A, metal alcalino, se encuentra en el 2º período, grupo 1.
El elemento B, gas noble, se sitúa en el 2º período, grupo 18.
El elemento C, metal alcalinotérreo, está situado en el 4º período, grupo 2.
El elemento D, no metal halógeno, se encuentra situado en el 4º período, grupo 17.
c) Los números cuánticos (2, 1, 0, +1/2), corresponden al electrón 2p del elemento B.
Esta combinación de números cuánticos, (3, 0, 1, +1/2), es imposible, pues si l = 0, nunca puede tomar ms el valor 1, ya que ms siempre toma los valores entre – l, … 0,…+ l.
La combinación (3, 2, 1, +1/2) coincide con los valores correctos de los números cuánticos, que corresponden con un electrón 3d, y no pertenece a ninguno de los elemento propuestos.
Por coincidir con los valores correctos de los números cuánticos, la combinación (4, 1, 1, +1/2)
corresponde a uno de los electrones 4p del elemento D.
d) El elemento B, gas noble y, por ello, muy estable, es el que posee menor reactividad química.
3--Para los elementos A, B, C y D, de números atómicos 3, 10, 20 y 35,
respectivamente:
a) Escribe la configuración electrónica de cada uno de ellos.
b) Indica su situación en la tabla periódica. (período y grupo).
c) Justifica si los siguientes números cuánticos pueden corresponder a los electrones más
externos de alguno de ellos, indicando a cuál: (2, 1, 0, + 1/2); (3, 0, 1,+ 1/2); (3, 2, 1, +
1/2); (4, 1, 1, + 1/2).
d) Justifica cuál de estos elementos tienen la menor reactividad química.
Solución:
a)
b) La situación de los elementos en un período se determina por el valor del número cuántico
principal n, mientras que el grupo se obtiene según el valor de los electrones en su capa de valencia.
El elemento A, metal alcalino, se encuentra en el 2º período, grupo 1.
El elemento B, gas noble, se sitúa en el 2º período, grupo 18.
El elemento C, metal alcalinotérreo, está situado en el 4º período, grupo 2.
El elemento D, no metal halógeno, se encuentra situado en el 4º período, grupo 17.
c) Los números cuánticos (2, 1, 0, +1/2), corresponden al electrón 2p del elemento B.
Esta combinación de números cuánticos, (3, 0, 1, +1/2), es imposible, pues si l = 0, nunca puede tomar ms el valor 1, ya que ms siempre toma los valores entre – l, … 0,…+ l.
La combinación (3, 2, 1, +1/2) coincide con los valores correctos de los números cuánticos, que corresponden con un electrón 3d, y no pertenece a ninguno de los elemento propuestos.
Por coincidir con los valores correctos de los números cuánticos, la combinación (4, 1, 1, +1/2)
corresponde a uno de los electrones 4p del elemento D.
d) El elemento B, gas noble y, por ello, muy estable, es el que posee menor reactividad química.
miércoles, 24 de octubre de 2012
martes, 23 de octubre de 2012
EXAMEN 1º BACHILLERATO
Tema 3, el martes que viene.
Ej para repasar
http://www.fqdiazescalera.com/pv_obj_cache/pv_obj_id_328431D45A07881EA20A1E76B2DBB8EC75DE0000/filename/09.pdf
lunes, 22 de octubre de 2012
Concepto de elemento, sustancia simple
Un elemento es entonces una sustancia pura de un cierto tipo de átomo, es decir, un cúmulo de millones de átomos iguales, por ejemplo una pepita de oro está constituida por millones de átomos de oro (Ag).
CN 2º Repaso para el examen del tema 1
Las sustancias simples son las que están compuestas únicamente por átomos del mismo tipo.
1. Oxígeno molecular (O2)
2. Una pepita de oro (Au)
3. Fósforo (P)
4. Nitrógeno molecular (N2)
5. Cloro gas (Cl2)
6. Carbono (C)
7. Hidrógeno (H2)
8. Plata pura (Ag)
9. Mercurio (Hg)
10. Plomo (Pb)
Las sustancias compuestas están formadas por distintos tipos de átomos.
1. Agua (H2O, hidrógeno y oxígeno)
2. Sal de mesa (NaCl, sodio y cloro)
3. Azúcar (Sacarosa, C12H22O11)
4. Amoniaco (NH3, nitrógeno e hidrógeno)
5. Ácido clorhídrido (HCl, hidrógeno y cloro)
6. Cloroformo (CHCl3, carbono, cloro e hidrógeno)
7. Ácido sulfúrico (H2SO4, hidrógeno, azufre y oxígeno)
8. Alcohol etílico o etanol (CH3CH2OH o C2H6O)
9. Acetona (CH3COCH3 o C3H6O)
10. Dióxido de carbono (CO2, carbono y oxígeno)
Concepto de descarga eléctrica en gases
Mira la siguiente información y haz un resumen en tu cuaderno.
Una descarga eléctrica en un medio gaseoso, es un fenómeno en el que un gas, que normalmente, no conduce la electricidad, empieza a hacerlo debido a la ionización de sus átomos, como consecuencia de la influencia de una fuente energética (de calor, de radiación o de un campo eléctrico, que provoca una diferencia de potencial entre los electrodos entre los que se sitúa el gas). La conducción eléctrica a través de este gas ionizado (en adelante, plasma) no sigue la ley de Ohm, sino que se rige por los procesos físicos elementales que se dan entre las partículas cargadas (electrones, iones, átomos y moléculas excitadas) transportadas en el plasma y producidas y absorbidas en los electrodos.
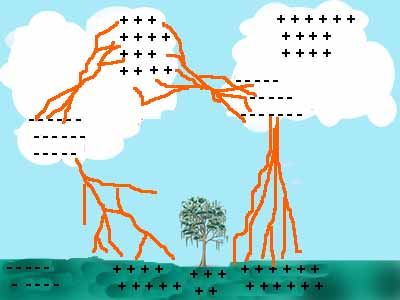
El rayo es la unión violenta de las cargas positivas y negativas, constituyendo una descarga eléctrica a través de gases de baja conductividad.
Una descarga eléctrica en un medio gaseoso, es un fenómeno en el que un gas, que normalmente, no conduce la electricidad, empieza a hacerlo debido a la ionización de sus átomos, como consecuencia de la influencia de una fuente energética (de calor, de radiación o de un campo eléctrico, que provoca una diferencia de potencial entre los electrodos entre los que se sitúa el gas). La conducción eléctrica a través de este gas ionizado (en adelante, plasma) no sigue la ley de Ohm, sino que se rige por los procesos físicos elementales que se dan entre las partículas cargadas (electrones, iones, átomos y moléculas excitadas) transportadas en el plasma y producidas y absorbidas en los electrodos.
El rayo es la unión violenta de las cargas positivas y negativas, constituyendo una descarga eléctrica a través de gases de baja conductividad.
Las descargas pueden ocurrir de nube a nube o de nube a tierra. Estas últimas son a las que nos referiremos, por ser las que provocan daños tanto en tierra, como en el agua.
Usualmente las nubes están cargadas negativamente en su base y positivamente en su parte superior. Por inducción electrostática la tierra resultará positiva inmediatamente debajo de tal nube. Se establece así una diferencia de potencial enorme, produciéndose el rayo cuando se vence la rigidez dieléctrica del medio (aire o vapor de agua). Simultáneamente con el rayo se produce la luz (relámpago) y sonido (trueno).
Aproximadamente la mitad de los rayos constituyen descargas simples y la otra mitad corresponde a rayos compuestos por descargas múltiples de rápida sucesión.
TAREA 2ºB CN
PAG. 29 LOS EJERCICIOS 21,22,23,24,25,y 27 que tiene que ver con las sustancias que explico en el aula.
PARA EL LIBRO VIEJO 26,28,29,35,
Os recuerdo que el examen es este viernes, entra TODO EL TEMA 1, Y LA HISTORIA DEL ÁTOMO QUE VIMOS EN EL AULA Y REPASAMOS.
ORGANIZACIÓN CLASES BA1ºD
Después de terminar de explicar el tema 3 en estas dos ultimas semanas nos queda terminar de hacer y corregir los ejercicios del tema para hacer el examen.
De tarea para hoy era los ej. 6 al 12 (incluidos).
OS RECUERDO QUE TODOS LOS DIAS PREGUNTO LA TEORIA.
Suscribirse a:
Entradas (Atom)