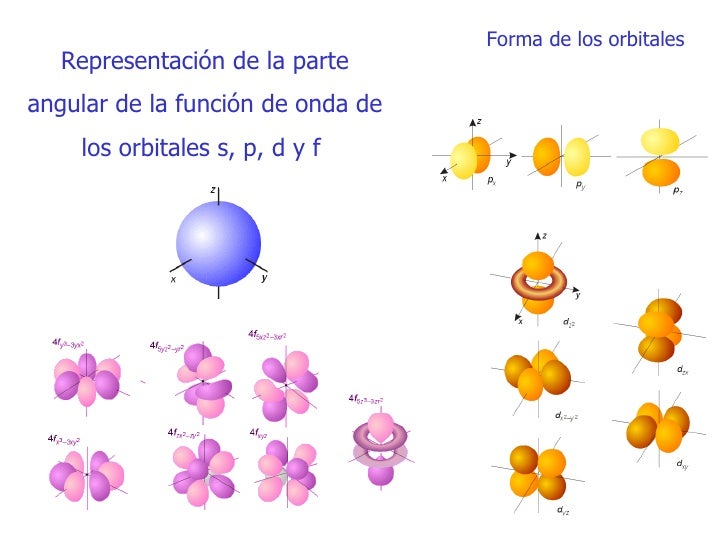
4C empieza este miercoles
4D empieza el lunes 10 dic, no se puede retrasar pues no da tiempo
Mas información en:
- http://quifi-mj.blogspot.com/search/label/Reacciones%20Quimica
- http://concurso.cnice.mec.es/cnice2005/35_las_reacciones_quimicas/curso/index.html
Fichas de ejercicios tema de A.Puebla:os doy el día de la recuperación 20-21 diciembre 2018 la ficha 1 y 2 como tarea de vacaciones,Traer corregidas con las soluciones y para después de vacaciones la ficha 3.
- Ficha 1: Ajuste de Reacciones Químicas. Solución Ficha 1.
- Ficha 2. Mol. Solución Ficha 2.
- Ficha 3. Cálculos estequiométricos. Solución Ficha 3. hacer vosotros el ejercicio y mirar sólo las soluciones....el procedimiento el que entendáis vosotros.
- ojo en las soluciones del ejercicio ha cambiado lo siguiente:
IUPAC La Unión Internacional de Química Pura y Aplicada, (IUPAC por sus siglas en inglés), define como condiciones normales, al término cualitativo que es usado de acuerdo al criterio del investigador, y que normalmente implica a la temperatura y presión de un determinado sitio. Es decir, se toma la temperatura representativa del lugar y su presión atmosférica, por lo que estas condiciones varían de un punto a otro. Las condiciones estándares para gases (tiene diferencia conceptual con las condiciones normales) que son adoptadas por la IUPAC, son: Temperatura: 273.15 K (0°C) Presión: 1x10^5 Pa (0.986 atm) Nótese que no se toma 1 atmósfera de presión.
Más información en: Condiciones normales [Standard conditions / Conditions normales] (Química) © https://glosarios.servidor-alicante.com
Condiciones Estándares: aprox 1 atm y 0ºC---22.4 l
Condiciones Normales: Presión y Temperatura del lugar. Depende de las condiciones a las cuales se esté haciendo el experimento, comúnmente para la presión es 1 atm, y la temperatura: 25ºC .
Por eso lo mejor es: